eISSN 2444-7986
DOI: https://doi.org/10.14201/orl.30933
ARTÍCULO DE REVISIÓN
ORBITOPATÍA TIROIDEA. PUNTOS CLAVE PARA EL DIAGNÓSTICO Y TRATAMIENTO
Thyroid orbitopathy. Tricks for diagnosis and treatment
Victoria MARQUÉS-FERNÁNDEZ 1; Alicia GALINDO-FERREIRO
1; Alicia GALINDO-FERREIRO 1; Jose Maria PALACIOS-MURES2; Maria del Mar VILLACORTA-MARTÍN
1; Jose Maria PALACIOS-MURES2; Maria del Mar VILLACORTA-MARTÍN
Hospital Universitario Río Hortega.1 Servicio de Oftalmología.2 Servicio de Endocrinología. Valladolid. España.
Correspondencia: ali_galindo@yahoo.es
Fecha de recepción: 18 de noviembre de 2022
Fecha de aceptación: 19 de abril de 2023
Fecha de publicación: 25 de mayo de 2023
Fecha de publicación del fascículo: 18 de diciembre de 2023
Conflicto de intereses: Los autores declaran no tener conflictos de intereses
Imágenes: Los autores declaran haber obtenido las imágenes con el permiso de los pacientes
Política de derechos y autoarchivo: se permite el autoarchivo de la versión post-print (SHERPA/RoMEO)
Licencia CC BY-NC-ND. Licencia Creative Commons Atribución-NoComercial-SinDerivar 4.0 Internacional
Universidad de Salamanca. Su comercialización está sujeta al permiso del editor
RESUMEN: La orbitopatía tiroidea (OT) es una patología autoinmune de etiología desconocida. Se trata de una enfermedad edematosa e inflamatoria crónica y a veces subaguda o aguda, cuyas características principales son edema palpebral, úlceras corneales, hipertensión ocular, exoftalmos generalmente bilateral, estrabismo restrictivo, diplopía y neuropatía óptica. El objetivo principal es realizar una revisión y actualización acerca del enfoque diagnóstico y terapéutico de la OT. Realizar una revisión y actualización acerca del enfoque diagnóstico, terapéuticos de la OT. Métodos: Revisión de la literatura publicada referente a la OT y manera actual de enfocar esta patología. Resultados: La OT es una enfermedad inflamatoria orbitaria con un posible origen autoinmune y que suele asociarse a trastornos metabólicos de la glándula tiroidea. Fisiopatológicamente su mecanismo no está claro. Afecta mayormente a mujeres y está negativamente influenciada por factores como el tabaquismo, la edad, el sexo y la raza. Es imprescindible clasificarla en cuanto a su severidad y su actividad para un correcto manejo. Conclusiones: El conocimiento clínico de OT es esencial para el diagnóstico precoz de la enfermedad. El tratamiento médico, en caso de OT activa, debe ser precoz, agresivo y acorde a la fase en que se presente el paciente con el fin de evitar las graves consecuencias de la OT. El tratamiento quirúrgico deberá ser lógico y ordenado, pero a su vez rápido, con el fin de devolver al paciente al entorno laboral, social y familiar.
PALABRAS CLAVE: órbita; tiroides; enfermedad de Graves; oftalmopatía; orbitopatía.
SUMMARY: Purpose: Thyroid orbitopathy (TO) is an autoimmune disease of unknown etiology. It is a chronic and sometimes subacute or acute edematous and inflammatory disease, the main characteristics of which are eyelid edema, corneal ulcers, ocular hypertension, generally bilateral exophthalmos, restrictive strabismus, diplopia and optic neuropathy. The main purpose of this work is to review and update the current diagnostic and therapeutic approaches. To propose a practical, basic and precocious approach based in the knowledge of the TO. Methods: Literature review and exposition of our experience in the management of TO. Results: TO is an inflammatory orbital disease that probably has an autoimmune origin and most of the time is related to systemic disorders of the thyroid gland. Pathogenesis of the disease is not yet fully understood. Women are more likely to develop TO, and the disease is clearly affected by several factors such as smoking, age, sex and race. It is crucial to determine TO severity and activity for a correct management. Conclusions: Clinical knowledge is essential for the early diagnosis of this disorder, and it is the most important factor for the proper management of the disease. The medical treatment must be initiated promptly and should be aggressive and based in the current phase of the disease, in order to avoid the severe damage that follows TO. The surgical approach must be logical and sequential, but, on the other hand, must be rapid and aggressive in order to return the patient to his/her labour, social and familiar environment.
KEYWORDS: orbit; thyroid; Graves’ disease; ophthalmopathy; orbitopathyrevise MeSH.
INTRODUCCIÓN
La orbitopatía tiroidea (OT) es una patología autoinmune de etiología desconocida. Se trata de una enfermedad edematosa e inflamatoria crónica y a veces subaguda o aguda, cuyas características principales son edema palpebral, úlceras corneales, hipertensión ocular, exoftalmos generalmente bilateral, estrabismo restrictivo, diplopía y neuropatía óptica [1]. Alrededor del 90% de OT se asocian a hipertiroidismo, 5% hipotiroidismo (como tiroiditis de Hashimoto), y 5% eutiroidismo [2]. Es conocida también con el nombre de oftalmopatía de Graves por su asociación con la enfermedad de Graves, considerándose la manifestación extratiroidea más frecuente de esta enfermedad [2]. Es la primera causa de patología orbitaria.
La incidencia de OT en enfermedad de Graves es del 50%, la gran mayoría solo presentará formas subclínicas y solo un 3-5% desarrollarán formas severas [3]. Tiene un predominio del sexo femenino [1]. La edad de presentación de la OT presenta rango de edad puede oscilar entre los 25 a 65 años. La edad media de presentación es ligeramente mayor en hombres que en mujeres.
Este artículo ofrece una actualización en la clínica, diagnóstico y manejo actual de la OT, siguiendo las guías de la EUGOGO 2021(European Group On Graves’s Orbitpathy, www.eugoggo.eu).
MATERIAL Y MÉTODO
Se realizó una revisión bibliográfica de las publicaciones referentes a la OT y a la manera actual de enfocar esta patología en las bases de datos PubMed, EMBASE y Cochrane Library. Los términos de búsqueda en idioma español e inglés fueron : “European Group on Graves’orbitopathy”; “Grave’s Disease” or “Grave’s orbitopathy”; “orbital decompression”; “orbitopathy management”; “surgical treatment in grave’s orbitopathy”; “glucocorticoids in grave’s orbitopathy”; “medical treatment in grave’s disease or grave’s orbitopathy”; “thyroid eye disease”;“orbitopatía tiroidea”; “manejo no quirúrgico de la orbitopatía tiroidea”; “tratamiento quirúrgico de la orbitopatía de Graves”, con más de 2600 resultados desde el año 2012 hasta noviembre de 2022.
RESULTADOS
Al tratarse nuestro trabajo de una actualización de las guías de diagnóstico y manejo de la OT nos hemos basado principalmente en las guías de la EUGOGO del año 2021 por ser estas las más recientes. No obstante, se han revisado y aportado datos de un total de 57 artículos añadiendo finalmente a la bibliografía de este manuscrito 37 referencias, cuatro de las cuales hacen referencia a revisiones de la EUGOGO entre ellas, la guía de manejo del año 2016.
DISCUSIÓN
FACTORES DE RIESGO
Dentro de los factores de riesgo de la OT están la disfunción tiroidea (hipertiroidismo y tiroiditis de Hashimoto), el tabaquismo y el tratamiento con iodo radioactivo.
Respecto al tabaco señalar que es el principal factor de riesgo de desarrollar una OT cuando existe enfermedad de Graves, puede empeorar una OT preexistente y el riesgo aumenta con el número de cigarrillos y disminuye al dejar de fumar [4].
CLÍNICA
Los signos y síntomas más frecuentes en la OT son los indicados en la Tabla 1.
Tabla 1. Signos y Síntomas de la orbitopatía Tiroidea (OT).
Córnea -conjuntiva |
Hiperemia bulbar, Queratoconjuntivitis límbica superior /sicca, Úlceras corneales |
párpados |
Edema, retracción palpebral |
Músculos extraoculares |
Miopatía restrictiva |
grasa |
Aumento volumen |
Glándula lagrimal |
Engrosamiento/ojo seco |
Nervio óptico |
Neuropatía óptica, alteración colores, defecto pupilar aferente |
Cuando recibimos una OT, lo primero que debemos hacer es clasificarla en función de su gravedad (leve, moderado-severo y muy severo/neuropatía óptica) y su actividad (activa e inactiva) [4].
La Clasificación de la gravedad en la OT de la EUGOGO se expone en la Tabla 2 [5].
Tabla 2. Clasificación de la gravedad en la OT de la Declaración de Consenso del Grupo Europeo sobre Orbitopatia de Graves (EUGOGO).
OT LEVE |
Pacientes con leve impacto en vida diaria, QoL Buena, insuficiente para justificar tratamiento inmunosupresor. Tiene solo 1 de las siguientes características: retracción palpebral<2mm, afectación leve tejidos blandos, exoftalmos<3mm, diplopía transitoria o ausente, exposición corneal que mejora con lubricantes. |
OT MODERADA-SEVERA |
Pacientes con gran impacto en vida diaria, QoL afectada, que justifica tratamiento inmunosupresor o quirúrgico. Tiene solo 1 de las siguientes características: retracción palpebral >2mm, afectación grave tejidos blandos, exoftalmos>3mm, diplopía constante. |
OT MUY SEVERA |
Pacientes con neuropatía óptica compresiva y/o alteración corneal severa por exposición. |
La EUGOGO establece parámetros para la puntuación de actividad clínica (PAC/CAS) que otorga 1 punto a cada uno de los elementos presentes, considerando una OT activa si PAC ≥ 3 (Tabla 3).
Tabla 3. Parámetros para la puntuación de actividad clínica (PAC) O CLINICAL ACTIVITY SCORE (CAS), EUGOGO.
En la primera visita y sucesivas |
Dolor ocular espontaneo Dolor ocular al movimiento Enrojecimiento palpebral Enrojecimiento conjuntival Edema párpados Edema conjuntival (quemosis) Edema o hiperemia carúncula |
A partir de la segunda visita |
Empeoramiento de exoftalmos >2mm Empeoramiento de MOE Pérdida de más de una línea Esnellen |
FISIOPATOLOGÍA
La fisiopatología de la OT no está clara aún. El hipertiroidismo está producido por la interacción de las inmunoglobulinas estimulantes del tiroides (TSI) con los receptores de TSH, existiendo un autoantígeno común al tejido tiroideo y a los tejidos orbitarios. En la OT nos encontramos con un aumento de volumen de los músculos extraoculares, de la grasa y del tejido conectivo al que se llega por un mecanismo de reconocimiento del antígeno que comparten tiroides y tejidos orbitarios por parte de los linfocitos T autorreactivos y los linfocitos T CD4+, segregando estos últimos citocinas que van a activar a los CD8+ y los fibroblastos que secretan glucosaminoglicanos, produciendo un efecto osmótico que edematiza el espacio retrorbitario, con el consiguiente edema periorbitario y muscular que conduce a la aparición de proptosis. Por otro lado, se produce un aumento del tejido graso de la órbita debido a la transformación hormono-dependiente de los fibroblastos en adipocitos; además existe una infiltración muscular de linfocitos, macrófagos y mastocitos que producen desestructuración-atrofia de dicha musculatura que altera su función. [6–8] Sin embargo hay pacientes con OT en los que no se detecta anti TSI. Se conoce que existen otros mecanismos implicados en la OT, como el derivado de la activación de los receptores del factor de crecimiento insulínico tipo 1 [9].
PROTOCOLO DE ACTUACIÓN ANTE UN PACIENTE CON ORBITOPATÍA TIROIDEA
Debemos mantener una estrecha relación entre el médico endocrino, el oftalmólogo, el otorrinolaringólogo y el médico de atención primaria para conocer el estado del paciente, dado que sin un correcto control endocrino no va a ser posible un buen control oftalmológico [10].
El papel del endocrino es fundamental para determinar los valores de hormonas tiroideas e hipofisarias (T3, T4, TSH), y el tratamiento más adecuado: fármacos antitiroideos, iodo radiactivo y/o tiroidectomía total o subtotal para conseguir el eutiroidismo [11].
Dentro de las tareas a desarrollar por parte del oftalmólogo, están las siguientes [12]:
• Exploración oftalmológica completa [13].
• Encuesta de calidad de vida de OT, de EUGOGO (QoL) Debe ser entregada en cada visita [14].
• TAC orbitario: con finalidades diagnósticas y terapéuticas para planificación quirúrgica en casos de descompresión. [15]
• Analíticas seriadas Anticuerpos anti TSI (anti-Trab).
Derivación a centros especializados
Tras una valoración del paciente por los médicos de atención primaria o por oftalmólogos generales, se debe decidir si el paciente debe ser evaluado y tratado por un centro especializado en pacientes tiroideos. A continuación exponemos determinados criterios que nos pueden ayudar a tomar esa decisión [12]:
• No remitir pacientes con antecedentes de enfermedad de Graves que no tienen síntomas ni signos de OT.
• Remitir pacientes con presentaciones poco habituales (OT unilateral o OT eutiroidea),
• Derivación urgente si:
• Deterioro inexplicable de la visión, conciencia de cambio en la intensidad o en la calidad de la visión del color en uno o en ambos ojos o antecedentes de subluxación ocular repentina.
• Opacidad evidente de la córnea, córnea expuesta cuando se cierran los párpados o inflamación de la papila óptica.
• Derivación no urgente:
• Ojos anormalmente sensibles a la luz, arenosos que no mejoran tras 1 semana de lubricantes tópicos, dolor detrás de los ojos, detección de un cambio progresivo en el aspecto de los ojos y/o los párpados en los últimos 1-2 meses causando preocupación en el paciente, diplopía.
• Existencia de retracción palpebral, inflamación o enrojecimiento anormal de párpado o conjuntiva, restricción de movimientos oculares, inclinación de la cabeza para evitar la visión doble.
MANEJO DE LA ORBITOPATÍA TIROIDEA
El oftalmólogo establecerá el tipo de tratamiento a emplear en la OT. Se pueden emplear diferentes opciones en función de las necesidades.
MédicTratamientos médicos:
• Medidas conservadoras oculares (a realizar en todos los pacientes)
• Bolos de metilprednisolona +/-micofenolato
• Radioterapia
• Terapia biológica
Tratamientos quirúrgicos:
• Descompresión orbitaria (DO)
• Cirugía del estrabismo
• Cirugía palpebral
TRATAMIENTO MÉDICO DE LA ORBITOPATÍA TIROIDEA [4] (FIGURA 1)

Figura 1. Algoritmo de tratamiento orbitopatía tiroidea (OT) activa 1ª línea de EUGOGO 2021.
Para cualquier OT independiente del grado, se aplicarán las siguientes medidas locales:
• Lubricantes tópicos (lágrimas artificiales y pomada durante la noche)
• Control hormonal estricto
• Dejar de fumar
Orbitopatía tiroidea leve
• Inactiva. Selenio 200microgr/día durante 6 meses desde el diagnóstico. Comparado con placebo, el selenio también mejoró los test de calidad de vida (GO-QoL). La suplementación con selenio a largo plazo se ha asociado con un riesgo aumentado de desarrollo de diabetes mellitus 2 [4, 16, 17].
Si la OT leve es estable y con la enfermedad inactiva podemos mantenerlo simplemente con observación. En aquellos casos en los que persista una retracción palpebral se puede realizar cirugía para corregirla siempre que se haya mantenido estable mínimo un año.
Se debe vigilar a los pacientes con OT leve inactiva porque un 15% de ellos en el tiempo se convertirán en OT moderada-severa.
• Activa. Asociada a una afectación grave de la Qol, justificaría el tratamiento con bolos de metilprednisolona durante 12 semanas
Orbitopatía tiroidea moderada-severa
• Inactiva. se valorará cirugía rehabilitadora
• Activa.
A- Esteroides. Son el tratamiento de elección para las formas moderadas-severas de la OT [18, 19].
Opción 1. OT moderada corticoides iv en forma de pulsos de metilprednisolona 500 mg una vez a la semana, [6 ciclos, y después otras 6 semana 250mgr/día].
Opción 2. OT severa, en los que exista diplopía constante o intermitente, proptosis severa y afectación severa de tejidos blandos. Se administrarán corticoides intravenosos en forma de pulsos de metilprednisolona 750 mg una vez a la semana i.v. sin asociar vía oral [6 ciclos, y después otras 6 semana 500 mgr/día].
Se emplea la vía intravenosa en pulsos en formas severas de OT que presenta menor tasa de efectos adversos que dosis altas de prednisona vía oral. Dosis altas de corticoides intravenosos (dosis acumulada mayor de 8 g) se han relacionado con fallo hepático y deben de ser evitadas.
Debemos tener en cuenta los siguientes puntos antes del tratamiento corticoideo:
• Control analítico completo con perfil hepático, renal y serologías (VHB, VHC, VIH, Quantiferón) y HbA1c para descartar situaciones de disfunción hepática, diabetes mellitus e infecciones sistémicas como Tuberculosis (Quantiferón), VIH o sífilis (treponema) A valorar, hipertensión arterial, antecedentes de úlcera, infección urinaria y glaucoma. Solicitaremos inmunoglobulinas IgG, A y M si tratamiento con rituximab.
• Si la prueba de quantiferón es positiva debe hacerse tratamiento de infección tuberculosa latente (isoniacida 9 meses, comenzando un mes antes del tratamiento inmunosupresor). A partir de los 65 años hay que valorar riesgo-beneficio ya que el riesgo de hepatotoxicidad grave aumenta al 5 %.
• Vacunación. La vacuna antineumocócica debe administrarse, al menos 2 semanas antes del inicio del tratamiento corticoideo:
■ No vacunados previamente: Vacuna antineumocócica 13 Valente (dosis única), seguida 6 meses después de la 23 Valente.
■ Vacunados con 13 Valente: Administrar dosis 23 Valente si ha pasado un año desde última vacunación
■ Vacunados con 23 Valente: Repetir 2 dosis adicionales separadas 5 años. Una sola dosis de revacunación después de los 65 años.
• Vacunación antigripal. Se recomienda la vacunación anual a todos los pacientes inmunosuprimidos.
• Se añadirá Trimetropin/Sulfametoxazol (Septrim forte®) 160/800 mg tres veces por semana, durante los tres meses de terapia esteroidea. Los pacientes bajo el efecto sistémico de fármacos inmunosupresores pueden verse afectados por infecciones oportunistas como Pneumocistis Carinni causantes de cuadros neumónicos severos [20–22]
B- MICOFENOLATO SODICO (MOFETIL) ORAL
El micofenolato inhibe de forma competitiva y reversible la inosina monofosfato deshidrogenasa, lo que da como resultado una disminución de la producción de anticuerpos por parte de las células B y un efecto antiproliferativo dual sobre las células B y T.
Se debe administrar en combinación con iv MP en bolos a dosis de 0,72gr/dia durante 24 semanas
OT activa moderada no respondedores a esteroides. Segunda línea de tratamento. Figura 2.
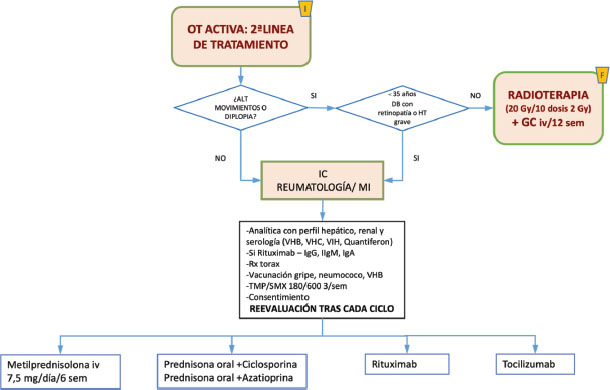
Figura 2. Algoritmo en orbitopatía tiroidea activa segunda línea en no respondedores a esteroides, adaptado EUGOGO 2021.
Se podrán tener en cuenta las siguientes opciones [19]:
A. Segunda administración de Bolos de MP iv, después de comprobar la función hepática, comenzando por 750mgr/día 6 semanas y seguido de 500mgr/día a la semana otras 6 semanas
B. Radioterapia externa (RT)
Si presenten diplopía o una motilidad restringida a pesar del tratamiento con esteroides, podemos recurrir a la radioterapia (RT) con corticoides iv simultáneos. La RT con dosis acumuladas inferiores (10 Gy) puede ser tan eficaz y mejor tolerada a que la RT con dosis mayores (20 Gy). Hay que tener precaución en pacientes menores de 35 años, diabéticos con retinopatía y en hipertensos graves. Se usa en pacientes con OT moderada – severa en los que los corticoides están contraindicados, no se toleran o son ineficaces. [23–25].
C.-Prednisona/prednisolona oral con ciclosporina [4, 26] La ciclosporina es un potente agente inmunosupresor que inhibe la vía de la calcineurina reduciendo la proliferación de células T y la secreción de IL-2. La combinación de ciclosporina (dosis inicial: 5–7,5 mg/kg de peso corporal/día) y prednisolona oral (dosis inicial: 50–100 mg/día) tuvo un mejor resultado y una menor tasa de recaída que la monoterapia con prednisolona oral. [26]
D.-Prednisona/prednisolona oral con azatioprina
La azatioprina es un agente antiproliferativo con un mecanismo de acción similar al del micofenolato, que se utiliza con frecuencia como "agente ahorrador de esteroides" en enfermedades autoinmunes/inflamatorias. La azatioprina fue ineficaz en GO como agente único [27], pero los estudios observacionales sugirieron beneficios en combinación con dosis bajas de glucocorticoides. [28]
Las dosis varían entre 100 y 200 mg al día dependiendo del peso del paciente. [29]
E.-Terapias biológicas.
Este tipo de fármacos se usan como alternativa a los glucocorticoides intravenosos o si falla la RT. De momento las indicaciones son como uso compasivo, pero parece que su uso en pacientes seleccionados puede ser, en un futuro próximo, una alternativa eficaz en el tratamiento de la OT. [4, 30]
Teprotumumab — El teprotumumab (Ac monoclonal anti receptor de IGF1) fue aprobado para el tratamiento de la OT por la FDA (US Food and Drug Administration) a inicios del año 2020. Tras ser establecido el beneficio del anticuerpo frente a placebo, en cuanto a reducción de la puntuación CAS y el grado de proptosis. Se administra cada semana durante 3 como una infusión intravenosa (10 mg/kg de dosis inicial y posteriormente 20 mg/kg) hasta un total de 8 infusiones. Nauseas (17 vs 9 %), diarrea (12 vs 8%), espasmos musculares (25 vs 7%), e hiperglucemia (10 vs 1 %) son los efectos secundarios que con mayor frecuencia fueron repostados en el grupo de teprotumumab. [9, 31] No está aprobado en España.
Tocilizumab — actúa sobre la interleucina 6 (IL 6) y se usa habitualmente en pacientes con artritis reumatoide. En la OT se ha estudiado para emplearlo en pacientes no respondedores a corticoides. En un ensayo randomizado, 32 pacientes con OT fueron asignados al grupo de tocilizumab (8 mg/kg) frente al grupo de infusión de placebo y se valoró la respuesta en cada grupo a las 0, 4, 8, y 12 semanas. En el grupo tratado con tocilizumab se observó una mejoría en el CAS a las 6 semanas (93.3 s 58.8 % con placebo) pero sin diferencias significativas entre ambos grupos a las 40 semanas [32]. El tratamiento con este fármaco exige monitorizar neutrófilos, plaquetas y transaminasas por si fuera necesario reducir a 4 mg/kg o interrumpir el tratamiento. [6]
Rituximab — En estudios observacionales, el rituximab, un anticuerpo monoclonal contra las células B, ha sido reportado tan eficaz como los corticoides sin los efectos secundarios de los mismos. Dos ensayos prospectivos presentaron resultados contradictorios debido principalmente a la diferencia entre el grado de actividad que presentaba cada paciente y la duración de la orbitopatía. [33, 34] Existe controversia sobre qué dosis usar en la OT variando entre 100 y 2000 mg; Campi y cols. En 2022 [35] publican un ensayo clínico randomizado el que comparan diferentes pautas de dosificación del rituximab y concluyen que la dosis más coste-eficiente es una única infusión de 500 mg, disminuyendo así el riesgo de efectos secundarios. Dosis más bajas, de 100 mg, también han sido evaluadas pero no consiguen inactivación completa de la OT o no es eficaz en la prevención de evolución a neuropatía óptica.
El rituximab , por tanto, está especialmente indicado en OT moderada-severa no respondedora a corticoides cuyo principal componente sea la afectación de tejidos blandos, ya que se ha observado, que este fármaco no produce mejoría clínica significativa en términos de proptosis ni diplopía. [36]
OT muy severa, con alto riesgo para la viabilidad ocular, bien sea por peligro de perforación ocular por lagoftalmos debido a gran proptosis o por neuropatía óptica distiroidea.
Tratar inmediatamente (con glucocorticoides intravenosos, metilprednisolona 1g/día durante 3 días seguidos o alternos (máximo 8 g) y al cuarto día se comienza con glucocorticoides orales 120 mg, no menos de 1 mg/kg/día en pauta descendente durante 3-4 meses y si no hay mejoría a 1 semana de inicio del tratamiento, proceder a la descompresión orbitaria urgente, de la pared medial, con o sin asociación de otras paredes.
TRATAMIENTO QUIRURGICO DE LA ORBITOPATÍA TIROIDEA
Una vez que el paciente con OT se encuentra INACTIVO durante al menos 6 meses, podemos comenzar a proponerle cirugía rehabilitadora. Se pueden realizar diferentes procedimientos en el siguiente orden siempre que sea necesario: descompresión orbitaria, cirugía de músculos extraoculares para corregir miopatía restrictiva y diplopía si existiese y por último cirugía palpebral.
CIRUGÍA DE DESCOMPRESIÓN ORBITARIA
Se contará con un equipo multidisciplinar en la programación de la cirugía, formado por cirujanos maxilofaciales, otorrinolaringología y cirujanos oftalmólogos-oculoplásticos.
Las indicaciones de DO son las siguientes:
• OT que causa proptosis y defecto estético.
• OT aguda muy severa que no responde a tratamiento médico
• OT progresiva que no responde a otras medidas
OTRAS INTERVENCIONES
1-Descompresión grasa, retirando el exceso de tejido adiposo retroocular ha sido realizada durante muchos años y puede producir una corrección cosmética en pacientes con OT moderada y proptosis.
2-Cirugía palpebral como Tarsorrafia lateral puede ser realizada para minimizar o prevenir el daño corneal en pacientes que tiene severa proptosis y no pueden cerrar sus ojos.
3-Cirugía del estrabismo y DO, la descompresión se debe de realizar en primer lugar y posteriormente se realizará la del estrabismo. El estrabismo en la OT se origina en la fibrosis postinflamatoria de uno o varios músculos, en uno o ambos ojos. Esto se manifiesta por un engrosamiento del vientre muscular que respeta los tendones, dando una imagen característica en la TC o RM. [37]
4-Cirugía palpebral. Se puede hacer cirugía de los parpados ante malposiciones del parpado inferior como del superior tras 4 meses de las anteriores cirugías.
CONCLUSIONES
La OT es una patología que vemos a menudo en nuestra consulta y que en muchas ocasiones pasa desapercibida. Por esta razón es importante mantener un alto nivel de sospecha.
Una vez diagnosticada la OT es fundamental establecer un tratamiento adecuado en base a las características y la gravedad del paciente ante el que nos encontramos, por eso la utilización de protocolos de tratamiento multidisciplinar nos facilita nuestra práctica clínica diaria.
En la actualidad el tratamiento de la OT se basa en medidas locales, glucocorticoides intravenosos, radioterapia y/o cirugía, dependiendo del estadío de la enfermedad; y en un futuro próximo parece que las nuevas terapias biológicas van a tener un mayor protagonismo.
BIBLIOGRAFÍA
1.Leo M, Mautone T, Ionni I, Profilo MA, Sabini E, Menconi F, et al. Variables affecting the long-term outcome of graves orbitopathy following high-dose intravenous glucocorticoid pulse therapy in patients not treated with orbital radiotherapy. Endocr Pract. 2016;22:1177–86.
2.Li Z, Cestari DM, Fortin E. Thyroid eye disease: what is new to know? Curr Opin Ophthalmol. 2018;29:528–34.
3.Al-Sharif E, Alsuhaibani AH. Fat-removal orbital decompression for thyroid associated orbitopathy: The right procedure for the right patient. Saudi J Ophthalmol. 2017;31:156–61.
4.Bartalena L, Baldeschi L, Boboridis K, Eckstein A, Kahaly GJ, Marcocci C, et al. The 2016 European Thyroid Association/European Group on Graves’ Orbitopathy Guidelines for the Management of Graves’ Orbitopathy. Eur Thyroid J. 2016;5:9–26.
5.Bartalena L, Baldeschi L, Dickinson A, Eckstein A, Kendall-Taylor P, Marcocci C, et al. Consensus statement of the European Group on Graves’ orbitopathy (EUGOGO) on management of GO. Eur J Endocrinol. 2008;158:273–85.
6.Taylor PN, Zhang L, Lee RWJ, Muller I, Ezra DG, Dayan CM, et al. New insights into the pathogenesis and nonsurgical management of Graves orbitopathy. Nat Rev Endocrinol. 2020;16:104–16.
7.Ludgate M. Fibrosis in dysthyroid eye disease. Eye. 2020;34:279–84.
8.Marcinkowski P, Hoyer I, Specker E, Furkert J, Rutz C, Neuenschwander M, et al. A new highly thyrotropin receptor-selective small-molecule antagonist with potential for the treatment of graves’ orbitopathy. Thyroid. 2019;29:111–23.
9.Smith TJ, Kahaly GJ, Ezra DG, Fleming JC, Dailey RA, Tang RA, et al. Teprotumumab for thyroid-associated ophthalmopathy. N Engl J Med. 2017. https://doi.org/10.1056/NEJMoa1614949.
10. Perros P, Baldeschi L, Boboridis K, Dickinson AJ, Hullo A, Kahaly GJ, et al. A questionnaire survey on the management of Graves’ orbitopathy in Europe. Eur J Endocrinol. 2006;155:207–11.
11. Effraimidis G. MANAGEMENT OF ENDOCRINE DISEASE: Predictive scores in autoimmune thyroid disease: are they useful? Eur J Endocrinol. 2019;181:R119–31.
12. Wiersinga WM, Perros P, Kahaly GJ, Mourits MP, Baldeschi L, Boboridis K, et al. Clinical assessment of patients with Graves’ orbitopathy: The European Group on Graves’ orbitopathy recommendations to generalists, specialists and clinical researchers. Eur J Endocrinol. 2006;155:387–9.
13. Ramli N, Kala S, Samsudin A, Rahmat K, Zainal Abidin Z. Proptosis - Correlation and Agreement between Hertel Exophthalmometry and Computed Tomography. Orbit. 2015;34:257–62.
14. Fayers T, Dolman PJ. Validity and reliability of the TED-QOL: A new three-item questionnaire to assess quality of life in thyroid eye disease. Br J Ophthalmol. 2011;95:1670–4.
15. Nkenke E, Benz M, Maier T, Wiltfang J, Holbach LM, Kramer M, et al. Relative en- and exophthalmometry in zygomatic fractures comparing optical non-contact, non-ionizing 3D imaging to the Hertel instrument and computed tomography. J Cranio-Maxillofacial Surg. 2003;31:362–8.
16. Negro R, Attanasio R, Grimaldi F, Marcocci C, Guglielmi R, Papini E. A 2016 Italian Survey about the Clinical Use of Selenium in Thyroid Disease. Eur Thyroid J. 2016;5:164–70.
17. Ventura M, Melo M, Carrilho F. Selenium and thyroid disease: From pathophysiology to treatment. International Journal of Endocrinology. 2017.
18. Xu N, Cui Y, Xie T, Zheng M. Comparative Efficacy of Medical Treatments for Thyroid Eye Disease: A Network Meta-Analysis. J Ophthalmol. 2018. https://doi.org/10.1155/2018/7184163.
19. Bartalena L, Kahaly GJ, Baldeschi L, Dayan CM, Eckstein A, Marcocci C, et al. The 2021 European Group on Graves’ orbitopathy (EUGOGO) clinical practice guidelines for the medical management of Graves’ orbitopathy. Eur J Endocrinol. 2021;185:G43–67.
20. Lehman JS, Kalaaji AN. Role of primary prophylaxis for pneumocystis pneumonia in patients treated with systemic corticosteroids or other immunosuppressive agents for immune-mediated dermatologic conditions. J Am Acad Dermatol. 2010;63:815–23.
21. Nieto-Ríos JF, Zuluaga-Quintero M, Aristizábal-Alzate A, Ocampo-Kohn C, Serna-Higuita LM, Ramírez-Sánchez IC, et al. Insuficiencia respiratoria hipoxémica grave por Pneumocystis jirovecii después de trasplante renal. Biomedica. 2018;38:32–6.
22. Calero-Bernal ML, Martin-Garrido I, Donazar-Ezcurra M, Limper AH, Carmona EM. Intermittent Courses of Corticosteroids Also Present a Risk for Pneumocystis Pneumonia in Non-HIV Patients. Can Respir J. 2016;2016.
23. Bartalena L. What to do for moderate-to-severe and active Graves’ orbitopathy if glucocorticoids fail? Clin Endocrinol (Oxf). 2010;73:149–52.
24. Viani GA, Boin AC, De Fendi LI, Fonseca EC, Stefano EJ, de Paula JS. Radiation therapy for graves’ ophthalmopathy: A systematic review and meta-analysis of randomized controlled trials. Arq Bras Oftalmol. 2012;75:324–32.
25. Dolman PJ, Rath S. Orbital radiotherapy for thyroid eye disease. Current Opinion in Ophthalmology. 2012.
26. Kahaly G, Yuan JP, Krause U, Hülbusch K, Beyer J. Ciclosporin and thyroid-stimulating immunoglobulins in endocrine orbitopathy. Res Exp Med. 1989. https://doi.org/10.1007/BF01855041.
27. Perros P, Weightman DR, Crombie AL, Kendall-Taylor P. Azathioprine in the treatment of thyroid-associated ophthalmopathy. Acta Endocrinol (Copenh). 1990;122:8–12.
28. Chalvatzis NT, Tzamalis AK, Kalantzis GK, El-Hindy N DS& PM. Safety and efficacy of combined immunosuppression and orbital radiotherapy in thyroid-related restrictive myopathy: two- center experience.itle. Eur J Ophthalmol 2. 2014.
29. Rajendram R, Lee RW, Potts MJ, Rose GE, Jain R, Olver JM, et al. Protocol for the combined immunosuppression & radiotherapy in thyroid eye disease (CIRTED) trial: A multi-centre, double-masked, factorial randomised controlled trial. Trials. 2008;9:1–17.
30. Strianese D. Efficacy and Safety of Immunosuppressive Agents for Thyroid Eye Disease. Ophthalmic plastic and reconstructive surgery. 2018.
31. Patel A, Yang H, Douglas RS. A New Era in the Treatment of Thyroid Eye Disease. Am J Ophthalmol. 2019;208:281–8.
32. Pérez-Moreiras JV, Álvarez-López A, Gómez EC. Treatment of active corticosteroid-resistant Graves’ orbitopathy. Ophthal Plast Reconstr Surg. 2014. https://doi.org/10.1097/IOP.0000000000000037.
33. Zhao LQ, Yu DY, Cheng JW. Intravenous glucocorticoids therapy in the treatment of Graves’ ophthalmopathy: A systematic review and Metaanalysis. Int J Ophthalmol. 2019;12:1177–86.
34. Salvi M, Vannucchi G, Currò N, Campi I, Covelli D, Dazzi D, et al. Efficacy of B-cell targeted therapy with rituximab in patients with active moderate to severe graves’ orbitopathy: A randomized controlled study. J Clin Endocrinol Metab. 2015;100:422–31.
35. Campi I, Vannucchi G, Muller I, Lazzaroni E, Currò N, Dainese M, et al. Therapy With Different Dose Regimens of Rituximab in Patients With Active Moderate-To-Severe Graves’ Orbitopathy. Front Endocrinol (Lausanne). 2022;12 January:1–9.
36. Burch HB, Perros P, Bednarczuk T, Cooper DS, Dolman PJ, Leung AM, et al. Management of thyroid eye disease: a Consensus Statement by the American Thyroid Association and the European Thyroid Association. Eur Thyroid J. 2022;11.
37. Szucs-Farkas Z, Toth J, Kollar J, Galuska L, Burman KD, Boda J, et al. Volume changes in intra- and extraorbital compartments in patients with Graves’ ophthalmopathy: Effect of smoking. Thyroid. 2005. https://doi.org/10.1089/thy.2005.15.146.